摘要:分析了国内外气体水合物相平衡测定方法,在恒温压力搜索法的基础上,通过合理的改进,设计了一套可以应用于反应盲釜中气体水合物相平衡判定的实验方法。以甲烷水合物相平衡实验为例,介绍了该改进方法的原理、操作步骤及实验结果,实验结果与软件预测结果吻合较好,误差在工程应用的允许范围内。
关键词:气体水合物;相平衡;纯气体水合物;压力搜索法;相平衡压力
A Judgment Method of Pure Gas Hydrate Phase Equilibrium
TANG Jianfeng,QIU Yuwen,CHEN Yuliang,LI Yuxing,ZHU Jianlu,LI Xuguang
Abstract:The measurement methods of gas hydrate phase equilibrium at home and abroad are analyzed.An experimental method applicable for judgment of gas hydrate phase equilibrium in the autoclave is designed by suitably modifying the isothermal pressure search method.Taking methane hydrate phase equilibrium experiment for example,the principle of the modified method,the operation procedures and the experimental result are introduced.The experimental result agrees well with the software prediction result,and the error is within the allowable range of engineering application.
Key words:gas hydrate;phase equilibrium;pure gas hydrate;pressure search method;phase equilibrium pressure
水合物早期的研究主要是为了解决油气工业生产过程中管道和设备的堵塞问题,随着在海洋和冻土带中大量天然气水合物的发现[1~2],其作为未来潜在能源得到许多国家政府和科研工作者的重视。此外,利用水合物处理二氧化碳温室气体和水合物法储运天然气新技术也日益受到重视[3~6]。气体水合物技术的实际应用已从最初的石油、天然气工业扩展到化工、能源、环境保护等领域[7]。在水合物资源开发和技术应用等各个研究领域中,相平衡条件测试是关键的基础技术之一,通过有效和快速的实验方法测定水合物相平衡条件,可为相关领域的深入研究奠定坚实基础。
1 水合物相平衡判定方法研究现状
利用水合物自身热力学特性,可判定是否达到水合物相平衡条件。目前,国内外常用的水合物相平衡测定方法可分为恒压法、恒温法、恒容法3种。若实验装置为带视窗的反应釜,则可采用恒压法或恒温法;若实验装置为不带视窗的反应盲釜,则可采用恒容法[8]。目前,发展较成熟的是直接观察法[9]和图形法[10],其他判定方法大多是在二者基础上发展起来。下面分别介绍4种判定方法。
① 直接观察法
通过反应釜视窗直接观察水合物的生成,从而判定水合物的相平衡,即为直接观察法。当温度一定时,充入气体的压力大于此温度下的相平衡压力,水合物才会形成。因此向反应釜内注入一定组成的气体至实验压力,搅拌并冷却,直至观察到水合物生成。当水合物生成后,将反应釜慢慢升温,至釜内仅有微量水合物存在时,停止升温。保持体系稳定4~6h,当温度和压力保持稳定,且釜内仍有微量水合物晶粒存在时,此时反应釜内的温度和压力即为水合物的相平衡条件。
② 图形法
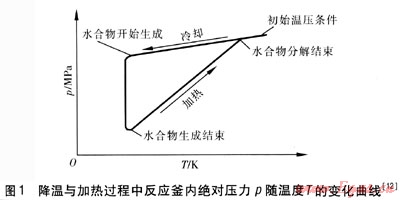
向反应釜内注入一定组成的气体至实验压力,然后缓慢降低反应釜温度,并在整个实验过程中记录温度和压力值。当体系过冷至足以生成水合物时,可以观测到明显的压力陡降;此时缓慢使反应釜升温,直至水合物完全分解。加热与降温过程中反应釜内绝对压力p随温度T的变化曲线交点即为水合物相平衡点。此方法在20世纪90年代就有人采用,至今还有实验室使用[11],特别适用于反应盲釜条件下,但其可靠性还需要通过重复实验进一步验证。降温与加热过程中反应釜内绝对压力p随温度T的变化曲线见图1[12]。
③ 质量分析法
文献[13]设计了一种质量分析法,该方法可用于反应盲釜,且反应釜内的温度可低于水的凝固点。此法是先将分子筛干燥剂用水饱和,然后降温,使之在真空的反应釜中结冰。保持该温度,将气体充入反应釜至实验压力。当分子筛干燥剂的质量增加时,说明有水合物生成,然后缓慢升温使水合物分解,此时分子筛干燥剂的质量减少,当质量停止变化时,记录此时的温度和压力值,即为水合物的相平衡条件。这种方法扩大了水合物相平衡的温压测定范围。
④ 压力搜索法
文献[14]设计了一种用于恒温下搜寻相平衡压力的方法,即压力搜索法。保持温度恒定,按一定的时间间隔记录压力,并从反应釜中取少量气样分析,得到恒定温度下的压力及气相组成变化情况。气样取出时,压力会下降,此时生成的水合物会分解来弥补降低的压力,当压力升高并稳定1~2h后,取气样进行分析,如此反复,直到气样的组成不再变化,此时的压力即可视为相平衡压力。文献[12]对该方法进行适当改进,提出应用于可视反应釜的压力搜索法,并获得较为满意的实验结果。
⑤ 4种方法的比较
将以上4种相平衡测试方法进行对比,见表1。
表1 4种相平衡实验测试方法对比
|
方法
|
实验周期/h
|
装置造价
|
可靠性
|
温压测定范围
|
其他
|
|
直接观察法
|
>48
|
视窗昂贵
|
误差较小
|
适于测水的凝固点以上
|
低于水的凝固点难以区分冰相和水合物相
|
|
图形法
|
>48
|
较低
|
需重复实验
|
可测温压区间宽
|
操作简单
|
|
质量分析法
|
>12
|
—
|
—
|
测定范围广
|
需实时监控样品质量增益
|
|
压力搜索法
|
>24
|
—
|
误差较小
|
可测定多组分
|
需色谱分析
|
此外,值得一提的是随着科技的迅速发展,为提高相平衡判定实验的直观性和准确度,一些高端水合物研究设备也在使用,比如显微成像系统、环境扫描电镜(ESEM)、X-射线衍射仪(X-ray)、核磁共振(NMR)等先进科研仪器[15]。它们的缺点是:对操作环境要求高,造价高,不适于广泛推广应用。
可见,以上几种方法都存在一定的不足,因此需要提出一种简单、易操作,对装置水平要求不高,且误差范围满足工程应用的水合物相平衡判定方法。
2 气体水合物相平衡实验判定方法改进
在实验和工程应用中发现水合物的生成点和分解点并不是水合物的相平衡点,这两个点会受到初始压力、反应溶液等因素的影响。而且只有当温度降至工作压力对应的平衡温度以下时水合物才会生成,过冷度越大,生成速度越快;温度升至工作压力对应的平衡温度以上时,水合物才会分解,过热度越大,分解速度越快。假设反应时间足够(甚至无穷),水合物可以在某个温度压力条件下(无过冷度或过热度)刚好生成或者分解,那么该点就是水合物的相平衡点。可见,水合物的相平衡状态是某种理想状态,在实际生产中由于诱导时间、“盔甲效应”以及其他环境因素的影响,水合物的相平衡状态几乎不可能达到,而可以测得的则是水合物开始生成点和开始分解点。
通过以上分析,本文在文献[14]设计的恒温压力搜索法的基础上进行改进,改进后的判定方法与以往方法的不同在于:①利用无搅拌式高压反应盲釜,盲釜是一种常见实验室装置,具有一定的通用性,这在一定程度上扩大了该方法的适用范围。②实验前简单估算反应溶液的用量,保证反应溶液过量,当水合物生成达到平衡时,则最终气相空间的压力即为相平衡压力。③在无色谱分析的情况下,仅适用于测定纯气体水合物相平衡。④实验周期明显缩短,在12h左右。
2.1 实验方法
2.1.1实验思路及方法
在恒定的反应釜容积下,保持实验温度不变,使水过量,充入甲烷,使反应釜内初始压力高于实验温度所对应的平衡压力。当有水合物生成,且反应釜内压力不再下降时,稳定1~3h之后,将反应釜内压力泄至实验温度对应的平衡压力以下,此时水合物大量分解,压力开始上升。当压力不再上升时,稳定1~3h,再充入甲烷,升压至实验温度对应的平衡压力以上,使水合物再次生成。如此反复几次,取其值最接近的升压后的压力值和降压后的压力值的平均值,作为该温度下的水合物相平衡压力值。
2.1.2水的过量估算
由于充入甲烷的初始压力高于实验温度对应的甲烷水合物相平衡压力,若加入的水量不足,水合物生成结束后气相空间还会剩余大量的甲烷气体,此时反应釜内的压力高于甲烷水合物相平衡压力,则无法进行实验测试,因此需要加入过量的水。当实际的水的物质的量与消耗的甲烷的物质的量之比,大于理想甲烷水合物分子式mCH4·nH20中的水、甲烷化学计量数之比n/m时,则理论上水是过量的。
采用气体状态方程求出平衡前后消耗的甲烷的物质的量△n:
△n=n1-n2 (1)
p0(Vc-V1)=Z1n1RT (2)
pe(Vc-1.25K)=Z2n2RT (3)
式中△n——平衡前后消耗的甲烷物质的量,mol
n1——初始充入甲烷的物质的量,mol
n2——平衡时甲烷的物质的量,mol
p0——初始反应釜内的绝对压力,MPa
Vc——反应釜的总体积,mL
V1——反应釜内水的体积,mL
Z1——初始温压下甲烷气体的压缩因子
R——摩尔气体常数,J/(mol·K),取8.314J/(mol·K)
T——实验温度,K
pe——平衡时反应釜内的绝对压力,MPa
Z2——平衡温压下甲烷气体的压缩因子
其中,压缩因子Z1,Z2可由P-R状态方程求解得到。
由于水合物与水之间的单位体积之差为4.6cm3/mol[16],因此,当水完全转化为水合物时,水合物的体积膨胀为原来水的体积的1.25倍。
由式(1)~(3)得到消耗的甲烷的物质的量△n,再由甲烷水合物的理想分子式mCH4·nH20得到气体与水的消耗量比(水的单位体积为18mL/mol):

由式(4)可以计算得到水完全转化成水合物的理论消耗水的体积V1。另外,由于气体生成水合物的过程中不可能完全按照理论分子式生成,因此需要有一个参数ф来表征实际消耗的水的物质的量与理论消耗的水的物质的量之比,ф值可以由实验确定。
为了保证水过量,所加入的水的物质的量还要有一个余量,一般视实际消耗的水量的大小而定。
2.1.3实例介绍
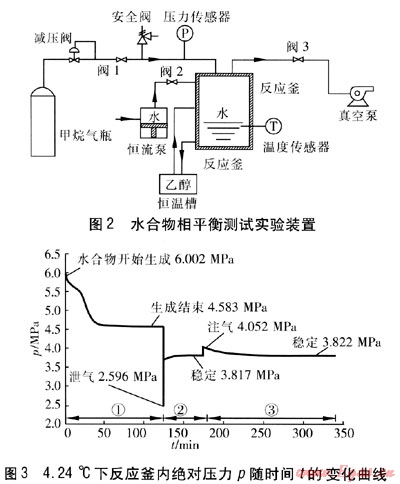
水合物相平衡测试实验装置见图2。实验气体为纯CH4,反应釜内初始绝对压力为6MPa,恒温槽温度为(4.24±0.05)℃,去离子水体积为80mL。实验操作步骤及现象如下:
将反应釜洗净,烘干,采用真空泵将管道和反应釜抽真空;关闭阀门3,打开阀门2,使用恒流泵向反应釜注入去离子水;关闭阀门2,打开阀门1,将减压阀出口绝对压力设定为6MPa,向反应釜内充入甲烷气体;关闭阀门1,开启恒温槽,采用乙醇作制冷液,使其在反应釜夹套内进行外循环对反应釜冷却,通过调节恒温槽的温度,使反应釜内部温度保持在4.24℃,随着反应釜内温度由室温下降至实验温度,反应釜内压力也随之下降,但幅度不大。随后进入水合物生成诱导期,由于无促进剂等反应加速条件,诱导期通常在8h以上。当压力突现陡降时说明水合物开始生成,此时开始记录反应釜内绝对压力p随时间t的变化,见图3。
阶段①:诱导期结束,反应釜内压力迅速下降,说明水合物快速生成,待压力逐渐稳定在4.583MPa附近约40min不变,说明水合物生成结束。
阶段②:反应釜内压力稳定后打开阀门3泄压,压力陡降至2.596MPa,随后迅速回升,并随时间呈上凸形状逐渐稳定在3.817MPa附近约30min不变。需要说明的是,泄气量不可过小,否则反应釜内压力变化不明显;泄气量也不应过大,否则水合物全部分解,实验失败。可以预测,当泄压结束时会出现以下几种情况,借此判定实验的进行程度:
a. 压力下降后没有出现或仅出现微小回升,则认为气相的减少没有打破水合物稳定状态,没有或仅有极少水合物分解,可以再增大泄气量。
b. 压力下降后迅速上升(约为10s内),且上升曲线斜率逐渐减小,压力稳定在实验预测结果附近,此时认为水合物迅速大量分解,补充了气相空间的压力降,同时由于水是过量的,压力将稳定在平衡压力附近,这是实验需要的结果。
c. 压力变化情况与第b条情况类似,但稳定后的压力明显低于实验预测结果,则说明泄气量过多,水合物几乎分解完全。
阶段③:压力上升达到稳定后注气至4.052MPa,压力曲线呈下凸形状随时间下降,并逐渐稳定在3.822MPa附近,若此压力值与阶段②稳定的压力值差值在±0.05MPa,则可以结束实验,取泄气和注气后稳定的绝对压力平均值,即为4.24℃下的纯甲烷水合物的相平衡压力;若差值超出±0.05MPa,需要重复以上阶段②、阶段③过程。
2.2 误差分析
将实验所测得的纯甲烷气体水合物相平衡数据、Csmhyd软件及Hysys软件计算值、以及文献[11]和文献[17]的实验结果对比,见图4。
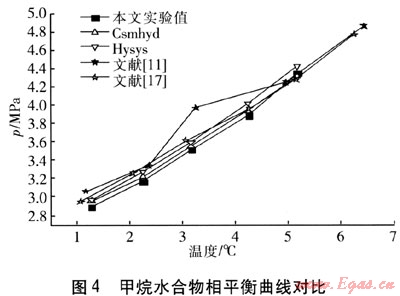
由图4可以看出,实验结果与软件计算值及以往的实验数据有很好的一致性。为了进一步验证本实验方法的可靠性,定义δCsm、δHys为实验数据相对于Csmhyd、Hysys软件计算值的相对误差,计算公式如下:

式中δCsm——本文实验值与Csmhyd软件计算值的相对误差
plab——实验测得的相平衡绝对压力,MPa
pCsm——Csmhyd软件计算的相平衡绝对压力,MPa
δHys——本文实验值与Hysys软件计算值的相对误差
pHys——Hysys软件计算的相平衡绝对压力,MPa
将相对误差结果列于表2。
表2 甲烷水合物相平衡实验数据与软件计算结果对比
|
温度/℃
|
1.26
|
2.24
|
3.16
|
4.24
|
5.17
|
|
|
甲烷水合物相平衡绝对压力/MPa
|
本文实验值
|
2.902
|
3.174
|
3.513
|
3.887
|
4.339
|
|
Csmhyd计算值
|
2.967
|
3.255
|
3.552
|
3.938
|
4.306
|
|
|
Hysys计算值
|
2.981
|
3.285
|
3.602
|
4.017
|
4.416
|
|
|
δCsm/%
|
2.19
|
2.48
|
1.09
|
1.29
|
0.77
|
|
|
δHys/%
|
2.72
|
3,49
|
2.53
|
3.34
|
1.77
|
|
由表2可以看出,本文实验数据与软件计算值的最大偏差为3.49%。实验所得的结果与Csmhyd软件及Hysys软件计算值有很好的一致性,这一点证实了实验的可靠性。
3 结论
本文总结了国内外几种常见水合物相平衡测试方法:直接观察法、图形法、质量分析法和压力搜索法。从实验周期、装置造价、可靠性、温压测定范围等几项指标分析了各自的优缺点,并在压力搜索法的基础上,通过改进得到一种适用于高压反应盲釜,且实验周期较短的气体水合物相平衡测试方法。它最大的优点在于要求的装置简单、通用性高、成本低,有利于普遍应用。通过实验数据与文献数据及软件计算值的对比,发现该测试方法的平均偏差较小,具有较高的可靠性,可以满足实际工程应用要求。
该方法的技术关键在于,根据反应釜容积、实验温度、初始压力、水合物理论含气率等参数,计算实验所用反应溶液的体积,并在此基础上保证水过量。
参考文献:
[1] 李焱.气体水合物生成条件的实验与模型预测的研究(硕士学位论文)[D].广州:华南理工大学,2004:3.
[2] SLOAN E D.Fundamental principles and applications of natural gas hydrates[J].Nature,2003(20):353-359.
[3] 唐建峰,李旭光,李玉星,等.天然气水合物稳定性实验[J].天然气工业,2008,28(5):125-128.
[4] 徐锋,吴强,张保勇.基于水合物技术的煤层气储运研究[J].煤气与热力,2008,28(6):A39-A40.
[5] 宋汉成,焦文玲,王秀全,等.基于水合物技术的天然气储运[J].煤气与热力,2006,26(12):4-6.
[6] 时国华,段常贵,荆有印.天然气水合物技术及供气可行性[J].煤气与热力,2006,26(4):22-24.
[7] 孙志高.气体水合物相平衡及储气特性研究(博士学位论文)[D].上海:上海交通大学,2002:2-5.
[8] JAVANMARDI J,MOSHFEGHIAN M,MADDOS R N.Simple method for prediction gas hydrate formation conditions in aqueous mixed-electrolyte solutions[J].Energy and Fuels,1998,12(2):219-222.
[9] TENG H,YAMASAKI A,SHINDO Y.Stability of the hydrate layer formed on the surface of a C02 droplet in high-pressure,low-temperature water[J].Chem.Eng.Sci,1996,51(22):4979-4986.
[10] SONG K Y,KOBAYASHI R.The water content of ethane,propane and their mixtures in equilibrium with liquid water or hydrates[J].Fluid Phase Equilibria,1994(95):198-281.
[11] 赵宏伟.海洋天然气水合物相平衡条件模拟实验及探测技术研究(博士学位论文)[D].长春:吉林大学,2005:21-30.
[12] 孙志高,石磊.气体水合物相平衡测定方法研究[J].石油与天然气化工,2001,30(4):164-166.
[13] HOLDER G D,GODBOLE S P.Measurement and prediction of dissociation pressures of isobutane and propane hydrates below the ice point[J].AIChE J,1982,28(6):930-934.
[14] HOLDER G D,JOHN V T.Thermodynamics of multicomponent hydrate forming mixture[J].Fluid Phase Equilibria,1983(14):353-361.
[15] 宁伏龙,蒋国盛,张凌,等.天然气水合物实验装置及其发展趋势[J].海洋石油,2008,28(2):68-72.
[16] 张凌伟.水合物法分离裂解气的实验及模拟研究(博士学位论文)[D].北京:石油大学(北京),2005:65.
[17] 梅东海,廖建.气体水合物平衡生成条件的测定及预测[J].高校化学工程学报,1997,11(3):225-230.
(本文作者:唐建峰 邱钰文 陈玉亮 李玉星 朱建鲁 李旭光 中国石油大学(华东)储运与建筑工程学院 山东青岛 266555)
您可以选择一种方式赞助本站

支付宝转账赞助

微信转账赞助
