摘要:氢气的储存有高压压缩、低温液化、金属氢化物等多种方式,利用水合物技术储存氢气是近年来发展起来的一项新技术。从水合物储氢的原理、技术性、经济性和安全性方面对水合物储氢技术进行了分析比较。水合物储氢技术的能耗与储能之比与高压压缩法相近,生产成本低于高压压缩法和低温液化法,而且安全性较高,是一种潜在的高效储气技术。
关键词:水合物;储氢;氢气储存
1 概述
氢能源因具有来源丰富、可再生、热效率高和燃烧清洁等特点而受到广泛重视,作为清洁能源可替代石油、天然气和煤等短缺的化石燃料,将成为21世纪的绿色能源[1]。氢气作为能源在我国的应用主要集中在民用和交通领域,城市现在大力推广天然气,在此之前多使用人工煤气,而人工煤气中就含有体积分数约50%的氢气,这是氢作为能源在民用领域的主要应用,目前仍占一定的比例。
随着氢能应用研究的不断深入,特别是氢内燃机汽车和以氢为燃料、通过化学作用产生电能作为动力的燃料电池汽车技术日趋接近大规模商业化应用,氢的储存技术显得十分重要。从某种意义上来说,氢气储存是氢能应用的瓶颈技术,大规模、经济、高效和安全储氢技术的发展将直接影响到氢能技术的推广应用,尤其是在车辆和移动工具方面。美国2003年氢燃料计划中50%的经费用于氢储运研究[2],储氢技术重要性可见一斑。
2 常用的氢气储存方法
由于氢具有质量轻,难以压缩,难以液化,易燃、易爆,高压下可透过容器壁,易与容器金属形成氢化物而产生氢脆的特点,因此探索和寻找适用于大规模储氢的技术将是一项重要的研究课题。常见的储氢技术一般基于化学反应,如通过氢化物的生成与分解储氢,或者基于物理吸附,当前大量的储氢研究是基于物理吸附的储氢方法[3]。
目前,氢气储存主要有物理法和化学法两大类。物理法主要有:高压氢气储存、低温液化储存、玻璃微球储存、活性炭吸附储存、地下岩洞储存、碳纳米管储存(也包含部分的化学吸附储存)、水合物储存。化学法主要有:储氢合金储存、有机液态氢化物储存、无机物储存等形式。衡量一种氢气储运技术的依据有储氢成本、储氢密度和安全性等方面。目前,氢气一般以高压压缩、低温液化、金属氢化物、有机氢化物和物理化学吸附等形式储存。衡量储氢性能的参数主要有两个:体积储氢密度和质量储氢密度。体积储氢密度为单位体积系统内储存氢气的质量,质量储氢密度为系统储存氢气的质量与整个储氢系统的质量(含容器、存储介质材料、阀及氢气等)之比。高压压缩储氢发展的历史较早,是比较传统而成熟的方法,无需任何材料作载体,只需耐压和绝热的容器,但是其储氢效率很低,加压到15MPa时质量储氢密度不超过3%,而且存在很大的安全隐患,成本也很高。低温液化方式储运虽然质量储氢密度高(可以达到14%),但液氢沸点仅20.38K,气化潜热小,仅0.921kJ/mol,而液氢的温度与外界的温度存在巨大的温差,因此稍有热量从外界传入容器,即会快速沸腾而损失。储氢合金的储氢容量较大,体积储氢密度是相同温度、压力条件下气态氢的1000倍,其体积储氢密度可高达40~50kg/m3,但其缺点是质量储氢密度低,多数储氢合金的质量储氢密度仅为1.5%~3%[4]。
相对于高压压缩储氢和低温液化储氢,金属氢化物、碳纳米管吸附、水合物储氢等固态材料氢气储存方法主要有以下潜在优势:较小的体积、较低的压力(更高的能源效率)和更多高纯度的氢气产出。压缩气体和液体储存如今是商业上可行的方法,但完全符合成本效益的储存系统还有待开发。另外还要关注储存方法的安全性,特别是对新的储存方法。从安全角度上考虑,在城市中建立储存20~70MPa压缩氢气的大容量储罐是不可行的。液化氢气需要给液化设备和储存设备不断供冷来维持20K或更低的低温。用水合物的形式储存氢气是近年来发展起来的一种物理储氢方法,该方法不但有较高的储氢效率,而且其原料(水或冰)也十分容易获得,另外,储存的温度也在液氮温区以上。由于氢气水合物中的氢分子是通过氢键与水分子结合的,并不需要形成化学键,所以释放从而利用氢气也容易得多,水合物储氢也适合于将氢气在常压下安全地储存。几种储氢系统相关储能参数见表1[5]。
表1 几种储氢系统相关储能参数[5]
|
储氢方法
|
储氢耗能/(kJ·kg-1)
|
释氢耗能/(kJ·kg-1)
|
耗能与储能之比
|
理论质量储能密度/(MJ·
Kg-1)
|
理论体积储能密度/(MJ·m-3)
|
|
20MPa压缩氢气
|
10300
|
0
|
0.O9
|
1.O5
|
714
|
|
35MPa压缩氢气
|
12264
|
0
|
0.10
|
8.04
|
2492
|
|
70MPa压缩氢气
|
14883
|
0
|
0.12
|
7.20
|
3599
|
|
液化氢气
|
42600
|
0
|
0.36
|
16.81
|
3999
|
|
低温金属氢化物
|
6226
|
1071
|
0.06
|
1.O8
|
13798
|
|
高温金属氢化物
|
10865
|
6724
|
0.15
|
3.47
|
12838
|
|
铝氢化物(NaAlH4)
|
10589
|
4080
|
0.12
|
3.47
|
11398
|
|
碳纳米管
|
15998
|
0
|
0.13
|
3.60
|
2159
|
|
水合物
|
11215
|
0
|
0.09
|
6.00
|
4979
|
Profio等[5]对几种储氢技术的储能参数进行了比较(见表1),综合考虑氢储存系统的稳定及温和的氢回收条件,单位质量氢与储存介质的相互作用所需能量约为40MJ/kg,其中,理论质量储能密度是指单位质量储存介质储存能量的大小,理论体积储能密度是指单位体积储存介质储存能量的大小。结果发现,几种制备储氢材料的耗能量与材料所储存的能量的比值中,液化氢气是最高的,水合物法与三种压力下的压缩氢气法的比值比较接近,因此,我们可以认为水合物储氢技术是可以作为静态的、大容量储氢最实际的选择之一。
3 水合物储气的原理及优势
笼型水合物是一种较为特殊的包络化合物,是由水分子与甲烷、乙烷、C02等小分子气体形成的非化学计量性笼状晶体物质,形成水合物的水分子被称为主体,形成水合物的其他组分被称为客体。主体水分子通过氢键相连形成一些多面体笼孔,尺寸合适的客体分子可填充在这些笼孔中,使其具有热力学稳定性。不同结构的水合物具有不同种类和配比的笼。空的水合物晶格就像一个高效的分子水平的气体储存器,每1m3水合物可储存160~180m3天然气。水合物的生成条件随客体分子种类的不同而千差万别,但所生成的水合物的晶体结构却不是随意变化的。到目前为止,已经发现的水合物结构有3种:Ⅰ型、Ⅱ型和H型,3种水合物晶体结构见图1。
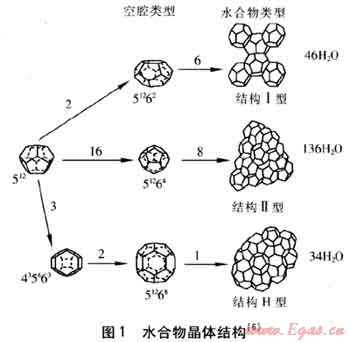
图1中多面体顶点的位置是氧原子,边代表氢键,512为由12个五边形所组成的多面体,51264为由12个五边形和4个六边形组成的多面体,其他类推;结构Ⅰ型水合物的单胞是由2个512和6个51262多面体组成的,单胞中共含有46个H20分子;结构Ⅱ型单胞是由16个512和8个51264多面体组成的,单胞中共含有136个H20分子;结构H型单胞是由3个512、2个435663和1个51268多面体组成的,单胞中共含有34个H20分子。表2为3种结构水合物的晶体结构特征参数,给出了平均晶穴半径(即多面体笼格内切球的半径)以及单位晶胞中所含水分子的个数等参数。
表2 3种结构水合物的晶体结构特征参数[6]
|
项目
|
结构Ⅰ型
|
结构Ⅱ型
|
结构H型
|
||||
|
晶穴规格
|
小
|
大
|
小
|
大
|
小
|
由
|
大
|
|
晶穴结构
|
512
|
51262
|
512
|
51264
|
512
|
43563
|
51268
|
|
晶穴数/个
|
2
|
6
|
16
|
8
|
3
|
2
|
1
|
|
平均晶穴半径/nm
|
0.395
|
0.433
|
0.391
|
0.473
|
0.394
|
0.404
|
0.579
|
|
单位晶胞水分子数/个
|
46
|
136
|
34
|
||||
|
晶体结构
|
体心立方体
|
面心立方体
|
六方体
|
||||
|
密度/(g·cm-3)
|
0.910
|
0.940
|
1.952
|
||||
利用水合物法储气的原理是:将气体和水在一定温度和压力条件下形成高储气量的水合物,然后以水合物的形式进行运输。采用水合物的方式储存氢气具有很多优点[7]:①储氢和放氢过程完全互逆。②储氢材料为水,水合物分解、氢气释放后的唯一副产物是良性、可重复利用的水,对环境没有污染。③水合物形成和分解时的动力学速度都非常快,能耗低。利用粉末冰合成氢气水合物只需要数分钟,利用块状冰形成氢气水合物也只需要约2h[8]。④氢气以分子的形态包含在水合物空穴中,在水合物释放氢气的过程中没有发生化学反应,分解过程非常安全且耗能低。⑤水在自然界中大量存在,资源丰富且价格低廉。⑥吸收和释放氢气所需的温度基本都在常温范围内。
4 水合物储存氢气的技术和经济分析
4.1 水合物储气的技术性
氢的储存技术是开发利用氢能的关键性技术,如何有效地对氢气进行储存,并且在使用时能够方便地释放出来,是该项技术研究的焦点。目前适合工业化的只有高压压缩氢气、液化氢气及合金储氢,前两种更为适用。一些储氢材料和技术离氢能的实用化还有较大的距离,在质量储氢密度、体积储氢密度、工作温度、可逆循环性能以及安全性等方面。还不能同时满足实用化要求。
氢水合物是固体,无腐蚀性,不可燃,具有多个氢分子填充水合物晶穴的特性,因此氢水合物具有较高的储氢能力,是一种安全且对环境友好的新的储氢技术。
水合物的生产条件随客体分子种类的不同而千差万别,由于氢分子比普通的多面体分子笼小很多,在1990年以前被认为不能形成水合物。1993年,Vos等[9]在非常高的压力下(750~3100MPa)发现了具有较小的笼结构的冰-Ⅱ型六边形H2+H20水合物,而且随着操作压力的不同,H2与H20的物质的量之比由1:6增大到1:1。但是从储存氢气的角度看,由于生成该水合物的压力太高,这次发现没有引起广泛重视。1999年,Dyadin第一次证明了纯的氢气水合物的存在,在压力为100~400MPa、温度为265~273K条件下,制备了普通六边形结构的氢水合物[10]。
2002年,Mao等[11]使用拉曼光谱法对H2+H2O系统进行了更细致的研究。研究表明,在227K、200MPa时可形成结构稳定的结构Ⅱ型纯的氢气水合物,晶胞的棱边边长为1.7047nm。进一步研究发现,氢水合物的小晶穴里填充2个氢分子,大晶穴则填充4个氢分子,这一发现引起广泛关注。
2004年,Lokshin等[12]用中子衍射法研究了氘气(D2)水合物,D2水合物的晶体结构由其生成温度和压力决定,调整压力和温度后,晶穴中最多可以容纳2~4个氘分子,而且D2水合物中氘分子之间的距离小于固态氢分子间的距离。这个研究结果表明水合物材料具有了储存氢气的潜能。
2004年,Florusse等[13]利用四氢呋喃(THF)、H2和水制备二元水合物,结果发现,THF存在时,在280K、5MPa下即可生成水合物,这一结果使形成水合物的条件与周围环境更加接近了。2005年,Lee等[14]利用拉曼光谱发现,摩尔分数为0.15%的THF水溶液形成的THF-H2二元水合物在12MPa、270K时,氢气质量分数为4.0%。这个发现使水合物向实用的储氢材料发展迈出了一大步。
随后,由于储氢的需求,作为备选的储氢技术——水合物储氢的研究得到了发展,美国[15]、日本[16]、加拿大[17]、韩国[18]和欧洲[19~20]已经开始了初步的实验研究和理论分析工作。
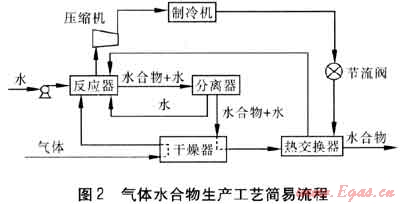
利用水合物形式进行气体储存的研究主要涉及到以下两种技术,一是利用水合物储运天然气或煤层气的技术[21~23],二是水合物储氢技术。水合物储运天然气技术已在日本进入应用实施阶段[24]。图2为气体水合物生产工艺简易流程。气体经干燥器干燥净化后与水在反应器中生成水合物、水的混合物。从反应器出来的混合物进入分离器,在分离器中进行初步分离。分离出的少量纯水由分离器下部引出,由于这部分水有一种保持晶体结构的趋势,故重新循环进入反应器;分离后得到的水合物经干燥器干燥,并经热交换器进一步降温后得到成品水合物。气体则从反应器排出后先进行压缩,提高气体压力,再经制冷机和节流阀进行降温处理,再回收重新利用。目前水合物储氢技术尚处于探索阶段。
4.2 水合物储存氢气的经济性
日本庆应大学Mori教授课题组[25]。在实验室研究的氢气水合物合成条件的基础上,分别针对用氢量大的工业园区和用氢量相对少的城市生活区设计了3000m3/h(即270kg/h)、500m3/h(即45kg/h)两种规模的氢气水合物生产厂,并配备了水合物冷藏井以方便氢气水合物能够在井中储存数月。根据目前氢气水合物基础研究的进展,Mori教授课题组设定了两种水合物生产的方案:一种是在间歇式反应釜中用冰和氢气生产纯氢气水合物,另一种是利用THF水溶液和氢气生产THF+H2二元水合物。他们依据Lokshin等的研究结果[12],在140K和35MPa条件下利用直径为0.5mm冰粒制备纯氢水合物,在223K和30MPa条件下利用THF水溶液制备H2+THF二元水合物,两种生产方式均能在30min内完成反应,表3为3000m3/h生成能力水合物制造厂所需的动力消耗[25],表3中纯氢水合物(1)是采用重复用冰方式生产的,纯氢水合物(2)是采用单次用冰方式生产的;电耗与储能比是指每1h耗电量与3000m3氢气所能产生的最大热能比,最大热能按照氢的高热值141.8MJ/kg计算为38240MJ。
表3 3000m3/h生成能力水合物制造厂所需的动力消耗[25]
|
项目
|
纯氢水合物(1)
|
纯氢水合物(2)
|
H2+THF二元水合物
|
||
|
LNG制冷
|
LNG制冷
|
无LNG制冷
|
LNG制冷
|
无LNG制冷
|
|
|
电功率/kW
|
1400
|
1500
|
4200
|
2100
|
5880
|
|
电耗与储能比
|
0.13
|
0.14
|
0.40
|
0.20
|
0.55
|
由表3可知,相同生产能力的水合物制造厂,采用纯氢水合物和H2O+THF二元水合物两种生产方式进行生产,若使用液化天然气(LNG)用于原料氢气的制冷均可以节省电能,从而使电耗与储能的比值降低;而重复用冰生产方式与单次用冰生产方式的电耗相差不大,说明重复用冰并不能大幅度节省电能,因此利用冰循环系统生成纯氢水合物节约的费用不是很多。
表4为水合物法储氢工厂的投资概算[25],这个概算不包括氢再气化系统。表5为储氢水合物厂的纯氢水合物气化系统的投资概算[25]。
从表4中可以看出,无论是电制冷还是LNG制冷,采用二元水合物生产方式制备储氢水合物的造价均比纯氢水合物的造价高40%~60%,这主要是由于THF水合物的生产设备(用于制备THF水合物)和二元水合物的反应器的费用均大于制冰设备和纯氢水合物反应器的费用,导致总造价的增加。
比较表5和表4可知,氢再气化系统的造价不超过工厂总造价的10%。另外,采用冰回收的方式会引起再气化系统造价的增加,但是增加的量很微小,可以不予考虑。
从表3~5可以看出,生产储氢水合物过程中制冷所消耗的电能占所储能的比例很大。如果将工厂建在LNG设施附近,那么可以通过利用LNG的冷能来减少制冷所需电能,这样利用水合物储气就更具有经济性。研究还发现,相同产率下,生产二元水合物比纯氢水合物在能耗及造价上都要高。
表6为各种储氢方法的基本建设费用比较。可以看出,虽然水合物储气技术还不完全成熟,正处于研究发展阶段,但与液化氢气和压缩氢气相比,储氢水合物在基本建设费用上比液化氢气和压缩氢气都要低,具有更多的优势,从而也证明了以水合物形式储存气体在经济上的可行性。
4.3 水合物储存氢气的安全性
由于氢气水合物是由水分子构成的笼状晶体中包络氢气分子而形成的固体化合物,其所包络的气体释放必须以冰晶骨架的溶化为前提,这使得水合物的分解需要吸收大量的热。由于水合物本身的绝热效应,即使暴露在大气中,水合物的分解受热传导的影响,气体的释放速度慢,不易发生由于气体大量泄漏可能导致的爆炸事故。
5 结语
自从水合物被发现以后,人们就一直尝试以水合物的方式来储存天然气和氢气。因为1m3的水合物可以储存标准状态下160~180m3的天然气,在1MPa、10℃的条件下,1m3的水合物可以储存标准状态下50m3的氢气。而且气体水合物可在0.1~1.0MPa、-15~0℃的条件下长期保存而分解量很小,比液化气体和压缩气体的储存、运输更为方便。气体水合物储存技术具有以下优势:
① 由于水合物分解需要较多的热量,只要切断传热途径,就可使气体水合物长期在常温下存在,而且由于水合物是固体,体积在短时间内不会突然膨胀,保证了储存和运输的安全性。
② 气体水合物固态储存可以代替危险性很大的压缩气体储存。
③ 因为水廉价易得,而水合物分解后又几乎可以释放出100%气体,可以提高气体的储存规模和效率。
目前水合物储气技术成熟度还较低,短期内还不能投入工业应用,但可预见其造价及运行费用较低,安全性较好,是一种潜在的高效储气技术。
参考文献:
[1] 任建伟,廖世军,刘军民.规模储氢技术及其研究进展[J].现代化工,2006,26(3):15-18.
[2] BRUMFEL G.Hydrogen cars fuel debate on basic research[J].Nature,2003,422(6928):104-105.
[3] 周理.简评储氢与制氢研究中的问题与进展[J].世界科技研究与发展,2006,28(6):17-22.
[4] 毛宗强.如何把氢储存起来[J].太阳能,2007(3):17-19.
[5] PROFIO P D,ARCA S,ROSSI F,et al.Comparison of hydrogen hydrates with existing hydrogen storage technologies:Energetic and economic evaluations[J].International Journal of Hydrogen Energy,2009,34(22):9173-9180.
[6] SLOAN E D.Fundamental principles and applications of natural gas hydrates[J].Nature,2003,426(6964):353-359.
[7] 常心洁,杨鲁伟,梁惊涛.水合物储氢技术的研究进展[J].材料导报,2009,23(10):83-86.
[8] LOKSHIN K,ZHAO Y.Fast synthesis method and phase diagram of hydrogen clathrate hydrate[J].Applied Physics Letters,2006,88(13):131909.
[9] VOS W L,FINGER L W,HEMLEY R J,et al.Novel H2-H20 clathrates at high pressures[J].Physical Review Letters,1993,71(19):3150-3153.
[10] DYADIN Y A,LARIONOV E G,ALADKO E Y,et al.Clathrate hydrates of hydrogen and neon[J].Mendeleev Commun,1999(5):209-210.
[11] MAO W L,MAO H K,GONCHAROV A F,et al.Hydrogen clusters in clathrate hydrate[J].Science,2002,297(5590):2247-2249.
[12] LOKSHIN K A,ZHAO YUSHENG,HE DUANWEI,et al.Structure and dynamics of hydrogen molecules in the novel elathrate hydrate by high pressure neutron diffraction[J].Physical Review Letters,2004,93(12):125503.
[13] FLORUSSE L J,PETERS C J,SCHOONMAN J.et al.Stable low-pressure hydrogen clusters stored in a binary clathrate hydrate[J].Science,2006,306(5695):469-471.
[14] LEE H,LEE J,KIM D Y,et al.Tuning clathrate hydrates for hydrogen storage[J].Nature,2005,434(7034):743-746.
[15] LOKSHIN K A,ZHAO YUSHENG,MAO W L,et al.Hydrogen clathrate hydrate:crystal structure,kinetics,phase diagram and possible applications[C]∥Tapir Academic Press.Proceedings of the Fifth International Conferenee on Gas Hydrates(ICGH-5).Trondheim(Norway):Curran Associates,Inc.,2005:1601-1604.
[16] HASHIMOTO S,SUGAHARA T,MORITOKI M,et al.Thermodynamic stability of hydrogen-tetra-n-butyl-ammonium bromide mixed gas hydrate in nonstoichio-metric aqueous solutions[J].Chemical Engineering Science,2008,63(4):1092-1097.
[17] OKUCHI T,MOUDRAKOVSKI L L,RIPMEESTER J A.Efficient storage of hydrogen fuel into leaky cages of clathrate hydrate[J].Applied Physics Letters,2007,91(17):171903.
[18] KIM D Y,PARK Y,LEE H.Tuning elathrate hydrates:Application to hydrogen storage[J].Catalysis Today,2007,120(3/4):257-261.
[19] INERBAEV T M,BELOSLUDOV V R,BELOSLUDOV R V.et al.Dynamics and equation of state of hydrogen clathrate hydrate as a function of cage occupation[J].Computational Materials Science,2006,36(1/2):229-233.
[20] TALYZIN A.Feasibility of H2-THF-H20 clathrate hydrates for hydrogen storage applications[J].International Journal of Hydrogen Energy,2008,33(1):111-115.
[21] 时国华,段常贵,荆有印.天然气水合物技术及供气可行性[J].煤气与热力,2006,26(4):22-25.
[22] 宋汉成,焦文玲,胡焱,等.基于水合物技术的天然气储运[J].煤气与热力,2006,26(12):4-7.
[23] 徐锋,吴强,张保勇.基于水合物技术的煤层气储运研究[J].煤气与热力,2008,28(6):B39-B43.
[24] WATANABE S,TAKAHASHI S,MIZUBAYASHI H.et al.A demonstration project of NGH land transportation system[DB/CD]∥Proceedings of the 6th Internaional Conference on Gas Hydrates(ICGH 2008).Vaneouver(British Columbia,Canada):[s.n.],2008.[2011-01-27].
[25] NAKAYAMA T,TOMURA S,OZAKI M,et al.Engineering investigation of hydrogen storage in the form of clathrate hydrates:conceptual design of hydrate produetion plants[J].Energy Fuels,2010,24(4):2576-2588.
[26] AMOS W A.Costs of storing and transporting hydrogen[R].Colorado(USA):National Renewable Energy Laboratory,1998.
(本文作者:郎雪梅 王燕鸿 樊栓狮 华南理工大学 化学与化工学院 传热强化与过程节能教育部重点实验室 广东广州 510640)
您可以选择一种方式赞助本站

支付宝转账赞助

微信转账赞助
